Cara Membaca Sistem Periodik Unsur
Konten dari Pengguna
30 Juni 2021 18:00 WIB
·
waktu baca 3 menitTulisan dari Berita Update tidak mewakili pandangan dari redaksi kumparan
ADVERTISEMENT
kumparan Hadir di WhatsApp Channel
Follow
Sudahkah kalian tahu bagaimana cara membaca tabel sistem periodik unsur dengan benar? Jika sudah, selamat! Jika belum, jangan khawatir! Artikel kali ini akan menjelaskan mengenai cara membaca sistem periodik unsur.
ADVERTISEMENT
Bagi kamu yang mempelajari ilmu pengetahuan alam, pasti sudah kenal dengan yang namanya sistem periodik unsur. Sistem periodik unsur kimia adalah susunan unsur-unsur berdasarkan nomor atom dan kemiripan sifat-sifatnya. Kamu perlu untuk mengenali, memahami, dan menghafalnya untuk menghitung reaksi kimia. Dengan tabel periodik, kamu bisa mengetahui nomor atom, konfigurasi elektron, dan sifat setiap unsur yang ada.
Cara Membaca Sistem Periodik Unsur
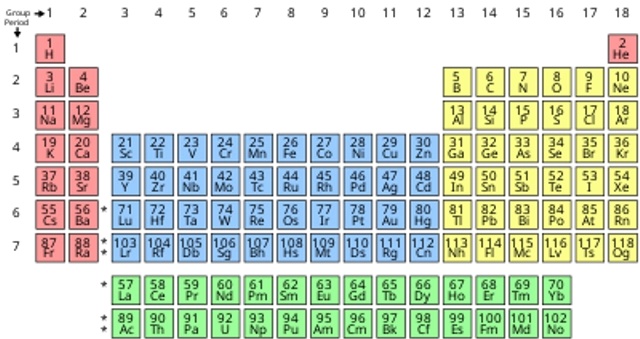
Coba baca urutan cara membaca ini sambil melihat tabel sistem periodik unsur ya! Salah satu contohnya ada di buku Sistem Periodik Unsur-unsur Kimia: untuk SMA dan Universitas, Redaksi Kawan Pustaka, 2011.
1. Baca tabel periodik dari kiri atas ke kanan bawah.
Unsur-unsur tersusun berdasarkan nomor atomnya. Semakin ke kanan dan ke bawah, maka nomor atomnya akan semakin besar. Nomor atom adalah banyaknya proton yang dimiliki atom unsur. Semakin ke kanan, kamu juga akan melihat bahwa nomor massa setiap atom bertambah besar. Semakin ke kanan atau ke bawah, massa atom unsur akan bertambah karena massa atom dihitung dengan menjumlahkan proton dan neutron di setiap atom unsur. Jumlah proton bertambah bersama unsurnya, yang berarti beratnya juga naik.
ADVERTISEMENT
2. Pahami bahwa setiap unsur mengandung 1 proton lebih banyak daripada atom di sebelah kirinya.
Kamu dapat mengetahui ini dengan melihat nomor atom. Nomor atom tersusun dari kiri ke kanan. Unsur-unsur juga dipisahkan menjadi 3 kelompok, kamu dapat melihat pengelompokannya pada tabel.
3. Kenali golongan atom, yang memiliki sifat fisik dan kimia yang sama.
Golongan ditunjukkan oleh kolom vertikal. Dalam banyak kasus, golongan dicirikan dengan warna yang sama. Hal ini membantumu mengidentifikasi unsur mana yang memiliki sifat fisik dan kimia yang mirip. Dengan begitu, kamu akan lebih mudah memperkirakan reaksi unsur-unsur tersebut. Setiap unsur pada golongan tertentu memiliki jumlah elektron yang sama pada orbital terluarnya.
4, Sebagian besar unsur hanya masuk ke satu golongan.
ADVERTISEMENT
Bedanya, hidrogen bisa dikelompokkan dalam golongan halogen atau logam alkali. Pada beberapa tabel, hidrogen muncul di kedua golongan tersebut.
Dalam banyak kasus, kolom akan diberi nomor 1-18, baik di atas maupun di bawah tabel. Angka-angka tersebut dapat ditampilkan dalam angka romawi (IA), angka arab (1A), atau angka (1).
5. Bacalah golongan atom mengikuti kolomnya dari atas ke bawah.
Perhatikan ruang kosong pada tabel. Selain berdasarkan nomor atom, penyusunan unsur-unsur ke dalam kelompok dan golongan juga mempertimbangkan sifat fisik dan kimia yang sama. Dengan cara ini, kamu akan lebih memahami cara setiap unsur bereaksi. Bertambahnya unsur kimia membuat penggolongannya semakin sulit sehingga tidak heran jika tabel periodik memuat ruang kosong.
6. Perhatikan bahwa setiap baris disebut periode.
ADVERTISEMENT
Semua unsur dalam satu periode memiliki jumlah orbital atom yang sama, yang nantinya akan dilintasi elektron. Jumlah orbital akan sesuai dengan jumlah periode. Tabel periodik memperlihatkan 7 baris, yang berarti terdapat 7 periode.
7. Bacalah periode unsur mengikuti barisnya dari kiri ke kanan.
Bedakan antara logam, semilogam, dan nonlogam. Kamu dapat lebih memahami sifat-sifat unsur dengan mengenali jenis unsur tersebut. Untungnya, sebagian besar tabel periodik menggunakan warna untuk menunjukkan apakah unsur tersebut masuk kelompok logam, semilogam, atau nonlogam.
Kamu bisa menemukan unsur logam di kanan tabel, sementara nonlogam di sisi kiri. Sedangkan untuk kelompok semilogam letaknya ada di antara logam dan nonlogam. (DNR)

